
|咨询电话
027-85516152 (工作日日间)
15327190618 (夜间节假日)

临床试验机构
Clinical Trial Organization
药物临床试验机构简介


药物临床试验机构简介
一、机构概况
为促进药物临床试验在我院高效优质开展,我院于2014年10月成立了药物临床试验机构(以下简称机构)。2017年5月15日获原国家食品药品监督管理总局“药物临床试验机构资格认定证书”。截止到2025年01月已有8个专业科室(包括感染性疾病、结核病、肝炎、艾滋病、胸外科、消化内科、重症医学和I期临床试验研究室)在药物临床试验机构备案管理平台完成备案,2020年11月成为国家第三批通过干细胞临床研究备案机构。各专业组技术力量雄厚、设施设备齐全、病源丰富,能满足I-Ⅳ期、干细胞临床研究及非注册类临床研究要求。

二、组织架构与管理
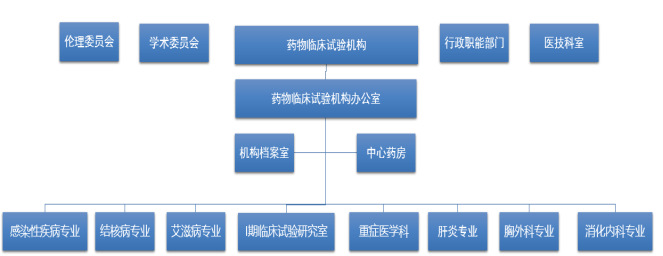
武汉市金银潭医院临床试验机构作为独立运作有监管职能的业务科室,由院长直接管理。下设临床试验机构办公室,负责全院药物临床试验、研究者发起的临床研究的立项、组织、协调、监督管理等工作。
药物临床试验机构组织架构图
三、平台建设成果
2019年我院成功申请获批“重大新药创制国家科技重大专项”课题“肺结核新药临床评价技术平台建设”,成为“十三五”期间69家国家GCP示范平台之一,是首家拥有国家级新药临床评价技术示范平台的武汉市级卫生单位,并高分高质量通过专项验收。2020年12月机构通过ISO 9001:2015质量管理体系认证,2023年11月通过ISO 9001:2015质量管理体系再认证,2024年我院临床生物样本资源中心获批国家人类遗传资源保藏资质,为药物临床试验的样本提供高质量高规格的存储条件。
自成立以来,我们已与多家知名药企及科研机构建立了长期合作关系,已承接超过400余项临床试验,涵盖I-IV期临床试验、生物等效性(BE)试验以及创新药物的研究,为产品的注册上市提供了强有力的支持。我们专注于传染病的研究,尤其在感染、病毒性肝炎、艾滋、结核病等重大传染病的临床试验中具有深厚的技术积累和丰富的项目经验。既往承接的临床试验项目中,已有24项药物临床试验(包含生物等效性试验)通过国家药监局数据核查。
为提高临床试验质量,保障受试者权益,保证试验数据的真实性,机构已建立并持续完善临床试验质量管理体系,对临床试验项目进行全流程管理,同时加强培训,不断提高研究人员GCP素养。
机构在应急期间充分发挥临床研究平台优势,通过科研创新和实践探索,推动三药三方-化湿败毒颗粒等近20款医药产品快速转移转化。
四、联系人及方式
机构办主任:刘颖
机构办副主任:刘雯
机构办秘书:何晶(药物注册类临床试验)
葛沁(非注册类的临床研究)
机构办地址:武汉市东西湖区银潭路1号科教楼3楼
机构接待时间:周一至周五(8:00-12:00,13:30-17:00)
联系电话:027-85509088
工作邮箱:whsjytyy_gcp@163.com
- 上一篇:医疗器械临床试验机构简介
- 下一篇:没有了



